introducción a la QUÍMICA, SESIÓN 1.
Hola estudiantes iniciamos introducción a la Química. A continuación se desarrollarán los contenidos y actividades para el proceso de aprendizaje de los conceptos bases de tan importante ciencia.1. ¿QUÉ ES LA CIENCIA?
Es el conjunto ordenado de conocimientos objetivos que hemos adquirido acerca de cómo es el mundo del que formamos parte. (Los conocimientos objetivos son aquellos relacionados con el objeto en sí mismo y no debidos a nuestro modo de pensar o de sentir). Para su estudio se hace una división de este conocimiento en diversas ramas: Geología, Biología, Química y Física, que estudian aspectos concretos de la naturaleza y, a su vez, se subdividen en otras muchas.
¿Para qué sirve la ciencia? ¿Cuál es su utilidad? ¿En qué consiste la actividad científica?
La ciencia médica investiga cómo encontrar la cura contra el Covid-19
Los usos, aplicaciones y productos indirectos de la ciencia son múltiples (su producto directo, sin duda, es el conocimiento). Pero puede decirse, en general, que la ciencia sirve para cuatro cosas: clasificar, explicar, predecir y controlar. Clasificar es un primer paso para entender. Da orden a lo que observamos, y nos permite ver con más profundidad, descubrimos relaciones que no eran apreciables a simple vista. Aunque describir, catalogar, enumerar y ordenar no son las actividades centrales de la ciencia, sí son pasos necesarios para iniciar el estudio de la naturaleza. Un segundo nivel- explicar- se considera esencial en la actividad científica: la generación de hipótesis que permitan darle sentido a lo observado: comprenderlo. Un tercer nivel: al describir y clasificar un sistema se hace posible predecir, se manifiesta cuando genera conocimiento de lo que todavía no sucede, cómo se comportará. El conocimiento científico, al aplicarse, nos permite controlar los sistemas en estudio, alterando su comportamiento. Es aquí cuando la actividad de hacer ciencia, que muchos conciben como pura y desligada de los problemas cotidianos, adquiere con más claridad una responsabilidad ética. Es al modificar la naturaleza, que podemos cometer errores y causar daño. Clasificar, explicar, predecir y controlar: cuatro dimensiones que muestran el poder y la utilidad de la ciencia.
Actividad 1.
Contesta las preguntas según el texto anterior y tu criterio:
1. ¿Para qué sirve la ciencia? y ¿cuál es su utilidad?
2. Realiza una reflexión mínimo de media hoja sobre el alcance de la ciencia en nuestro entorno actual con la situación del Covid-19.
1.1. EL MÉTODO CIENTÍFICO
Los conocimientos que la humanidad posee actualmente sobre las diversas ciencias de la naturaleza se deben, sobre todo, al trabajo de investigación de los científicos. El procedimiento que éstos emplean en su trabajo es lo que se llamará MÉTODO CIENTÍFICO.
El método científico –en síntesis– consta de las siguientes fases:
- Observación (de la cual nace el Planteamiento del Problema)
- Formulación de hipótesis
- Experimentación
- Emisión de conclusiones
Esquema del Método Científico para el estudio y solución de un problema u observación
NOTA: Para una mayor apropiación de los conceptos, amplíe las definiciones de los pasos a seguir en el método científico.
Aplicación del método científico por parte de los bebés, quienes son científicos innatos
Actividad 2.
Lee el siguiente texto:
“Imagina que te sientas a ver un rato la televisión y al apretar el control, no se enciende la tele. Repites la operación tres veces y nada. Miras si el control está bien, cambias las pilas y sigue sin encenderse la TV. Te acercas a la TV y pruebas directamente con sus mandos. Pero sigue sin funcionar. Compruebas si está desconectada, pero está conectada y no funciona. Buscas interruptores de la sala, no se encienden las luces. Compruebas en otras habitaciones y tampoco. Sospechas que el problema está en la caja de control central. Vas a inspeccionarla y te das cuenta que había saltado. Reconectas y todo funciona de nuevo, incluida la TV”.
Este proceso sigue una estrategia que desarrollamos muchas veces de manera inconsciente en la vida cotidiana y que se asemeja mucho al método científico. Escribe en una tabla el paso a paso de las acciones realizadas antes de lograr que la TV funcionara, de tal manera que correspondan al método científico.
Actividad 3.
Lee la siguiente situación y resuelve los interrogantes de este estudio de casos:
Luis es estudiante del noveno ciclo de la facultad de enfermería de la Universidad. Para participar en la Feria Científica, el desea investigar como la temperatura del agua afecta la rapidez con que se disuelve una tableta de Alka- Seltzer.
Contesta y realiza:
1. ¿Cuál es el problema que Luis desea investigar?
2. ¿Qué materiales necesita Luis para llevar a cabo su experimento?
3. ¿Cuál puede ser la hipótesis de la Investigación?
4. ¿Cuál es la variable independiente y dependiente en la investigación?
5. Diseña un experimento para comprobar la hipótesis de Luis. Construye una tabla para recopilar las observaciones y presenta tus resultados. Importante tomar evidencias fotográficas del experimento realizado.
2. MATERIA Y ENERGÍA

Relación entre la materia y la energía
Como recordarás, materia es todo lo que nos rodea, es todo aquello que tiene masa y ocupa un lugar en el espacio. La química es la ciencia que estudia la materia, sus propiedades, su constitución
cualitativa y cuantitativa, los cambios que experimenta, así como las variaciones de energía que acompañan a las transformaciones en las que interviene.
El ciclo del carbono ejemplifica cómo a partir de la energía del sol, las plantas (materia) usan la fotosíntesis (cambios físicos y químicos) para transformar el Carbono y el agua en azúcares, los cuales dan energía a los seres vivos, que, como las plantas, están hechos de moléculas de Carbono
2.1 Propiedades de la materia
Diferentes propiedades y magnitudes de la materia ordinaria
2.1.1 Propiedades generales o extrínsecas
Las propiedades generales son las propiedades comunes a toda clase de materia; es decir, no nos proporcionan información acerca de la forma como una sustancia se comporta y se distingue de las demás. Las propiedades generales más importantes son:
■ Masa, cantidad de materia que tiene un cuerpo.
■ Volumen, espacio que ocupa un cuerpo.
■ Peso, resultado de la fuerza de atracción o gravedad que ejerce la Tierra sobre los cuerpos.
■ Inercia, tendencia de un cuerpo a permanecer en estado de movimiento o de reposo mientras no exista una causa que la modifique y se relaciona con la cantidad de materia que posee el
cuerpo.
■ Impenetrabilidad, característica por la cual un cuerpo no puede
ocupar el espacio que ocupa otro cuerpo al mismo tiempo.
■ Porosidad: es la característica de la materia que consiste en presentar
poros o espacios vacíos.
2.1.2 Propiedades específicas o intrínsecas
Las propiedades específicas son características de cada sustancia y permiten diferenciar un cuerpo de otro. Las propiedades específicas se clasifican en propiedades físicas y propiedades químicas.
■ Propiedades físicas. Son las que se pueden determinar sin que los cuerpos varíen su naturaleza. Entre las propiedades físicas se encuentran:
— Propiedades organolépticas: son aquellas que se determinan a través de las sensaciones percibidas por los órganos de los sentidos. Por ejemplo, el color, el olor, el sabor, el sonido y la
textura.
— Estado físico es la propiedad de la materia que se origina por el grado de cohesión de las moléculas. La menor o mayor movilidad de las moléculas caracteriza cada estado. Aunque tradicionalmente estamos acostumbrados a referirnos a tres estados de la materia: sólido, líquido y gaseoso; investigaciones recientes proponen la existencia de otros estados, los cuales se producen, sobre todo, en condiciones extremas de temperatura y presión. Estos nuevos estados corresponden al estado de plasma y el superfluido.
El plasma es un estado que adoptan los gases cuando se calientan a elevadas temperaturas del orden de 10.000 °C. En el universo la mayoría de materia se encuentra en este estado debido a las altas temperaturas que poseen las estrellas.
El superfluido es un estado que se consigue cuando un gas, como el helio, se licúa a altas presiones y temperaturas cercanas al cero absoluto. La sustancia se comporta como un líquido que trepa por las paredes y escapa. Presenta muy poca fricción y viscosidad.
— Punto de ebullición: es la temperatura a la cual una sustancia pasa del estado líquido al estado gaseoso.
— Punto de fusión: es la temperatura a la cual una sustancia pasa del estado sólido al estado líquido.
— Solubilidad: es la propiedad que tienen algunas sustancias de disolverse en un líquido a una temperatura determinada.
— Densidad: es la relación que existe entre la masa de una sustancia y su volumen. Por ejemplo, un trozo de plomo pequeño es más denso que un objeto grande y liviano como el corcho.
— Dureza: es la resistencia que oponen las sustancias a ser rayadas. Se mide mediante una escala denominada escala de Mohs que va de uno hasta diez. Así, por ejemplo, dentro de esta escala el talco tiene una dureza de uno (1), mientras que el diamante presenta un grado de dureza de diez (10).
— Elasticidad: es la capacidad que tienen los cuerpos de deformarse cuando se aplica una fuerza sobre ellos y de recuperar su forma original cuando la fuerza aplicada se suprime.
— Ductilidad: mide el grado de facilidad con que ciertos materiales se dejan convertir en alambres o hilos.
— Maleabilidad: mide la capacidad que tienen ciertos materiales para convertirse en láminas, como el cobre o el aluminio. En general, los materiales que son dúctiles también son maleables.
— Tenacidad: es la resistencia que ofrecen los cuerpos a romperse o deformarse cuando se les golpea. Uno de los materiales más tenaces es el acero.
— Fragilidad: es la tendencia a romperse o fracturarse.
■ Propiedades químicas. Son las que determinan el comportamiento de las sustancias cuando se ponen en contacto con otras. Cuando determinamos una propiedad química, las sustancias cambian o alteran su naturaleza. Por ejemplo, cuando dejamos un clavo de hierro a la intemperie durante un tiempo, observamos un cambio que se manifiesta por medio de una fina capa de óxido en la superficie del clavo. Decimos entonces que el clavo se oxidó y esto constituye una propiedad química tanto del hierro como del aire; el primero por experimentar una oxidación y el segundo por producirla.
Algunas propiedades químicas son:
— Combustión: es la cualidad que tienen algunas sustancias para reaccionar con el oxígeno, desprendiendo, como consecuencia, energía en forma de luz o calor.
Vídeos sobre apuntes de química y propiedades de la materia
2.2 Transformaciones de la materia
Procesos donde la materia (agua) cambia de estado según la energía cinética asociada a sus moléculas
2.2.1 Transformaciones físicas
Son aquellas transformaciones o cambios que no afectan la composición de la materia. En los cambios físicos no se forman nuevas sustancias. Se dan cambios físicos cuando ocurren fenómenos como los siguientes: el aroma de un perfume se esparce por la habitación al abrir el frasco que lo contiene; al añadir azúcar al agua, el azúcar se disuelve en ella. En estos ejemplos, el perfume se evapora y el azúcar se disuelve. Cada una de estas transformaciones se produce sin que cambie la identidad de las sustancias; sólo cambian algunas de sus propiedades físicas por lo que se dice que ha sucedido una transformación física.
También son cambios físicos, los cambios de estado, porque no se altera la composición o naturaleza de la sustancia. Los cambios de estado dependen de las variaciones en las fuerzas de cohesión y de repulsión entre las partículas.
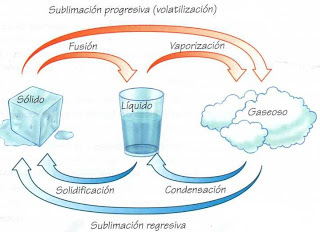
Son cambios de estado la fusión, la solidificación, la vaporización, la condensación y la sublimación.
■ Fusión: es el paso del estado sólido al estado líquido.
■ Solidificación: es el proceso inverso a la fusión, es decir, es el cambio
del estado líquido al estado sólido.
■ Vaporización: es el paso de líquido a gas por acción del calor.
■ Condensación: es el proceso inverso a la evaporación, es decir, es el
cambio de gas a líquido.
■ Sublimación progresiva: es el paso del estado sólido al estado gaseoso
sin pasar por el estado líquido.
■ Sublimación regresiva: es el proceso inverso a la sublimación progresiva. Del estado gaseoso se pasa al estado sólido al bajar la temperatura.
2.2.2 Transformaciones químicas
Son aquellas transformaciones o cambios que afectan la composición de la materia. En los cambios químicos se forman nuevas sustancias. Por ejemplo cuando ocurren fenómenos como los siguientes: un papel arde en presencia de aire (combustión) y un metal se oxida en presencia de aire o agua (corrosión), podemos decir que cambió el tipo de sustancia, convirtiéndose en otra diferente: por eso se dice que se produjo una transformación química.
En las transformaciones químicas se producen reacciones químicas. Una reacción química se da cuando dos o más sustancias entran en contacto para formar otras sustancias diferentes. Es posible detectar cuándo se está produciendo una reacción química porque observamos cambios de temperatura, desprendimiento de gases, etc.
3. CLASIFICACIÓN DE LA MATERIA
Esquema de la clasificación de la materia
Fuente: Libro Química 1, Santillana
Actividad 4.
Diligencia y completa la Tabla 1 al clasificar las diferentes sustancias según corresponda. Seleccione cinco (5) sustancias que encuentre en su hogar y clasifíquelas al igual que las primeras cinco (5) sustancias de la Tabla 1.
Tabla 1. Clasificación de las sustancias según sus propiedades
Clasifica
las diferentes sustancias según corresponda
|
|||||||
No.
|
SUSTANCIA
|
Elemento
|
Compuesto
|
Sustancia
pura
|
Mezcla heterogénea
|
Mezcla homogénea
|
Estado
|
1
|
Oro
|
||||||
2
|
Café +
Leche
|
||||||
3
|
Agua
|
||||||
4
|
Sangre
|
||||||
5
|
Oxígeno
|
||||||
6
|
|||||||
7
|
|||||||
8
|
|||||||
9
|
|||||||
10
|
|||||||
Actividad 5.
Diligencia y completa la Tabla 2 al clasificar los diferentes ensayos experimentales que realizará en casa, según corresponda. Argumente su selección de acuerdo a las observaciones que realice en cada ensayo. Tome evidencias fotográficas de cada ensayo.
Tabla 2. Clasificación de ensayos experimentales según sean cambios físicos o químicos
Clasifique
sus ensayos según corresponda
|
||||
No.
|
ENSAYO
|
Cambio
físico
|
Cambio
químico
|
Argumente
su selección y deje sus observaciones
|
1
|
Tome un
cubo de hielo y déjelo a temperatura ambiente
|
|||
2
|
Mezcle
agua con sal
|
|||
3
|
Mezcle
zumo de limón con bicarbonato de sodio
|
|||
4
|
Con sumo
cuidado queme un papel
|
|||









Juan David Bernal
ResponderEliminarel trabajo fue de mucha importancia y ayuda para adquirir mis conocimientos, el cual siento que desarrolle habilidades y destrezas sobre dichos temas.